 优先审批条件宽 从国家局所列的优先审批的原则来看,规则是相当宽泛。,其他有相关品种品种也密切关注优先审批哦。下面是儿童药的优先获批条件。 (一) 新药申请:应满足以下任一条件。 1、针对严重威胁儿童生命或者影响儿童生长发育,且目前无有效治疗目前无有效治疗药物或治疗手段疾病申请; 2、相比现有的治疗手段,具明显优势申请。 (二) 改剂型或新增规格的申请:同时满足以下两个条件。 1、现有的药品说明书中包含有确定的“儿童用法量” 的申请; 2、现行的剂型或规格均不适用于儿童, 新增的剂型或规格适合于儿童的申请。 (三) 仿制药申请: 对于目前市场短缺的儿童用药,实行优先审评。仿制申报厂家的数目为多家申请的,按照申请先后排队顺序,按照申请先后排队顺序,对排第一位的优先审评,若经优先审评不符合要求,则取消优先资格,后面的同品种申请可按序增补替代。 其他7类有优先权的品类 预计国家药审中心还会陆续公布其他类药品有限审评名单,其他7类药物也可以重点关注其中的重磅产品,其他7类药品分别是: (一)防治艾滋病、恶性肿瘤、重大传染病和罕见病等疾病的创新药注册申请; (二)儿童用药注册申请; (三)老年人特有和多发疾病用药注册申请; (四)列入国家科技重大专项和国家重点研发计划的药品注册申请; (五)使用先进技术、创新治疗手段、具有明显治疗优势的临床急需用药注册申请; (六)转移到中国境内生产的创新药注册申请; (七)申请人在欧盟、美国同步申请并获准开展药物临床试验的新药临床试验申请,或在中国境内用同一生产线生产并在欧盟、美国同步申请上市且已通过其药品审批机构现场检查的药品注册申请; (八)临床急需且专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。
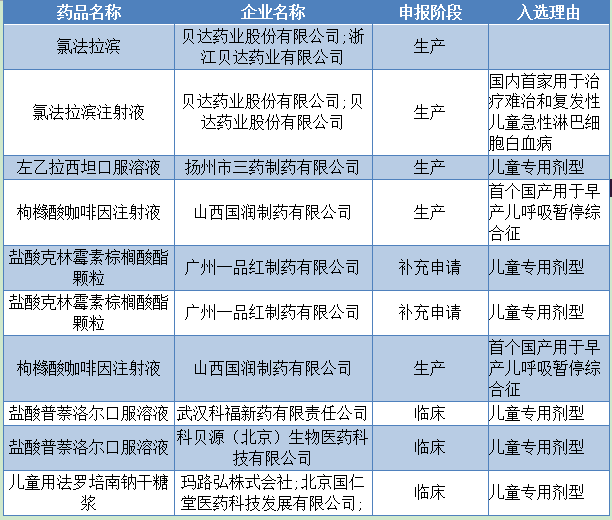
优先审批条件宽 从国家局所列的优先审批的原则来看,规则是相当宽泛。,其他有相关品种品种也密切关注优先审批哦。下面是儿童药的优先获批条件。 (一) 新药申请:应满足以下任一条件。 1、针对严重威胁儿童生命或者影响儿童生长发育,且目前无有效治疗目前无有效治疗药物或治疗手段疾病申请; 2、相比现有的治疗手段,具明显优势申请。 (二) 改剂型或新增规格的申请:同时满足以下两个条件。 1、现有的药品说明书中包含有确定的“儿童用法量” 的申请; 2、现行的剂型或规格均不适用于儿童, 新增的剂型或规格适合于儿童的申请。 (三) 仿制药申请: 对于目前市场短缺的儿童用药,实行优先审评。仿制申报厂家的数目为多家申请的,按照申请先后排队顺序,按照申请先后排队顺序,对排第一位的优先审评,若经优先审评不符合要求,则取消优先资格,后面的同品种申请可按序增补替代。 其他7类有优先权的品类 预计国家药审中心还会陆续公布其他类药品有限审评名单,其他7类药物也可以重点关注其中的重磅产品,其他7类药品分别是: (一)防治艾滋病、恶性肿瘤、重大传染病和罕见病等疾病的创新药注册申请; (二)儿童用药注册申请; (三)老年人特有和多发疾病用药注册申请; (四)列入国家科技重大专项和国家重点研发计划的药品注册申请; (五)使用先进技术、创新治疗手段、具有明显治疗优势的临床急需用药注册申请; (六)转移到中国境内生产的创新药注册申请; (七)申请人在欧盟、美国同步申请并获准开展药物临床试验的新药临床试验申请,或在中国境内用同一生产线生产并在欧盟、美国同步申请上市且已通过其药品审批机构现场检查的药品注册申请; (八)临床急需且专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。 国家食药监总局发布国《关于药品注册审评审批若干政策的公告》(2015年第230号) ,文件提到要加快8类临床急需等药品的审批,其中一类就是儿童用药。 昨日,药品审批审评中心发布了实行优先审评审批的儿童用药注册申请第一批名单以及优先审批的原则,有10个品种大大受益,可说是收割利好。 原因是在药企纷纷撤回药品注册申请的时候,保留品种所剩无几的情况下,这些品种的审批速度将会大大加快,其中还有四个申报生产的品种,更是值得重点关注。  优先审批条件宽 从国家局所列的优先审批的原则来看,规则是相当宽泛。,其他有相关品种品种也密切关注优先审批哦。下面是儿童药的优先获批条件。 (一) 新药申请:应满足以下任一条件。 1、针对严重威胁儿童生命或者影响儿童生长发育,且目前无有效治疗目前无有效治疗药物或治疗手段疾病申请; 2、相比现有的治疗手段,具明显优势申请。 (二) 改剂型或新增规格的申请:同时满足以下两个条件。 1、现有的药品说明书中包含有确定的“儿童用法量” 的申请; 2、现行的剂型或规格均不适用于儿童, 新增的剂型或规格适合于儿童的申请。 (三) 仿制药申请: 对于目前市场短缺的儿童用药,实行优先审评。仿制申报厂家的数目为多家申请的,按照申请先后排队顺序,按照申请先后排队顺序,对排第一位的优先审评,若经优先审评不符合要求,则取消优先资格,后面的同品种申请可按序增补替代。 其他7类有优先权的品类 预计国家药审中心还会陆续公布其他类药品有限审评名单,其他7类药物也可以重点关注其中的重磅产品,其他7类药品分别是: (一)防治艾滋病、恶性肿瘤、重大传染病和罕见病等疾病的创新药注册申请; (二)儿童用药注册申请; (三)老年人特有和多发疾病用药注册申请; (四)列入国家科技重大专项和国家重点研发计划的药品注册申请; (五)使用先进技术、创新治疗手段、具有明显治疗优势的临床急需用药注册申请; (六)转移到中国境内生产的创新药注册申请; (七)申请人在欧盟、美国同步申请并获准开展药物临床试验的新药临床试验申请,或在中国境内用同一生产线生产并在欧盟、美国同步申请上市且已通过其药品审批机构现场检查的药品注册申请; (八)临床急需且专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。
优先审批条件宽 从国家局所列的优先审批的原则来看,规则是相当宽泛。,其他有相关品种品种也密切关注优先审批哦。下面是儿童药的优先获批条件。 (一) 新药申请:应满足以下任一条件。 1、针对严重威胁儿童生命或者影响儿童生长发育,且目前无有效治疗目前无有效治疗药物或治疗手段疾病申请; 2、相比现有的治疗手段,具明显优势申请。 (二) 改剂型或新增规格的申请:同时满足以下两个条件。 1、现有的药品说明书中包含有确定的“儿童用法量” 的申请; 2、现行的剂型或规格均不适用于儿童, 新增的剂型或规格适合于儿童的申请。 (三) 仿制药申请: 对于目前市场短缺的儿童用药,实行优先审评。仿制申报厂家的数目为多家申请的,按照申请先后排队顺序,按照申请先后排队顺序,对排第一位的优先审评,若经优先审评不符合要求,则取消优先资格,后面的同品种申请可按序增补替代。 其他7类有优先权的品类 预计国家药审中心还会陆续公布其他类药品有限审评名单,其他7类药物也可以重点关注其中的重磅产品,其他7类药品分别是: (一)防治艾滋病、恶性肿瘤、重大传染病和罕见病等疾病的创新药注册申请; (二)儿童用药注册申请; (三)老年人特有和多发疾病用药注册申请; (四)列入国家科技重大专项和国家重点研发计划的药品注册申请; (五)使用先进技术、创新治疗手段、具有明显治疗优势的临床急需用药注册申请; (六)转移到中国境内生产的创新药注册申请; (七)申请人在欧盟、美国同步申请并获准开展药物临床试验的新药临床试验申请,或在中国境内用同一生产线生产并在欧盟、美国同步申请上市且已通过其药品审批机构现场检查的药品注册申请; (八)临床急需且专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。
 优先审批条件宽 从国家局所列的优先审批的原则来看,规则是相当宽泛。,其他有相关品种品种也密切关注优先审批哦。下面是儿童药的优先获批条件。 (一) 新药申请:应满足以下任一条件。 1、针对严重威胁儿童生命或者影响儿童生长发育,且目前无有效治疗目前无有效治疗药物或治疗手段疾病申请; 2、相比现有的治疗手段,具明显优势申请。 (二) 改剂型或新增规格的申请:同时满足以下两个条件。 1、现有的药品说明书中包含有确定的“儿童用法量” 的申请; 2、现行的剂型或规格均不适用于儿童, 新增的剂型或规格适合于儿童的申请。 (三) 仿制药申请: 对于目前市场短缺的儿童用药,实行优先审评。仿制申报厂家的数目为多家申请的,按照申请先后排队顺序,按照申请先后排队顺序,对排第一位的优先审评,若经优先审评不符合要求,则取消优先资格,后面的同品种申请可按序增补替代。 其他7类有优先权的品类 预计国家药审中心还会陆续公布其他类药品有限审评名单,其他7类药物也可以重点关注其中的重磅产品,其他7类药品分别是: (一)防治艾滋病、恶性肿瘤、重大传染病和罕见病等疾病的创新药注册申请; (二)儿童用药注册申请; (三)老年人特有和多发疾病用药注册申请; (四)列入国家科技重大专项和国家重点研发计划的药品注册申请; (五)使用先进技术、创新治疗手段、具有明显治疗优势的临床急需用药注册申请; (六)转移到中国境内生产的创新药注册申请; (七)申请人在欧盟、美国同步申请并获准开展药物临床试验的新药临床试验申请,或在中国境内用同一生产线生产并在欧盟、美国同步申请上市且已通过其药品审批机构现场检查的药品注册申请; (八)临床急需且专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。
优先审批条件宽 从国家局所列的优先审批的原则来看,规则是相当宽泛。,其他有相关品种品种也密切关注优先审批哦。下面是儿童药的优先获批条件。 (一) 新药申请:应满足以下任一条件。 1、针对严重威胁儿童生命或者影响儿童生长发育,且目前无有效治疗目前无有效治疗药物或治疗手段疾病申请; 2、相比现有的治疗手段,具明显优势申请。 (二) 改剂型或新增规格的申请:同时满足以下两个条件。 1、现有的药品说明书中包含有确定的“儿童用法量” 的申请; 2、现行的剂型或规格均不适用于儿童, 新增的剂型或规格适合于儿童的申请。 (三) 仿制药申请: 对于目前市场短缺的儿童用药,实行优先审评。仿制申报厂家的数目为多家申请的,按照申请先后排队顺序,按照申请先后排队顺序,对排第一位的优先审评,若经优先审评不符合要求,则取消优先资格,后面的同品种申请可按序增补替代。 其他7类有优先权的品类 预计国家药审中心还会陆续公布其他类药品有限审评名单,其他7类药物也可以重点关注其中的重磅产品,其他7类药品分别是: (一)防治艾滋病、恶性肿瘤、重大传染病和罕见病等疾病的创新药注册申请; (二)儿童用药注册申请; (三)老年人特有和多发疾病用药注册申请; (四)列入国家科技重大专项和国家重点研发计划的药品注册申请; (五)使用先进技术、创新治疗手段、具有明显治疗优势的临床急需用药注册申请; (六)转移到中国境内生产的创新药注册申请; (七)申请人在欧盟、美国同步申请并获准开展药物临床试验的新药临床试验申请,或在中国境内用同一生产线生产并在欧盟、美国同步申请上市且已通过其药品审批机构现场检查的药品注册申请; (八)临床急需且专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。






