 备注:未经特殊说明的均为共有关键项目,各类型企业均需遵守的,以下同。 2、厂房与设施,计8项
备注:未经特殊说明的均为共有关键项目,各类型企业均需遵守的,以下同。 2、厂房与设施,计8项 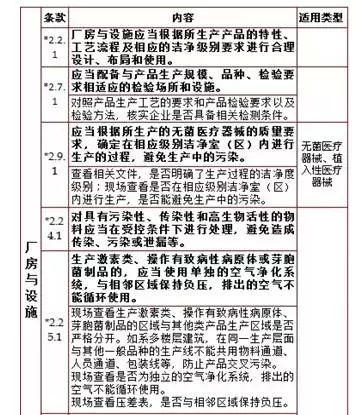
 3、设备,计3项
3、设备,计3项 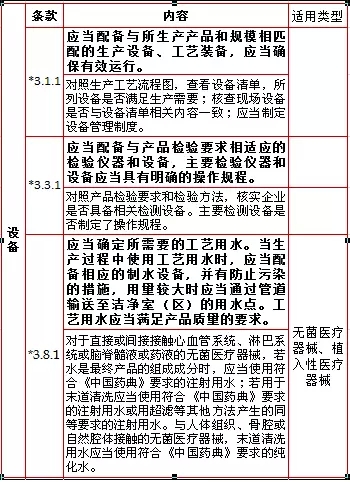 4、文件管理,计2项
4、文件管理,计2项  5、设计开发,计2项
5、设计开发,计2项 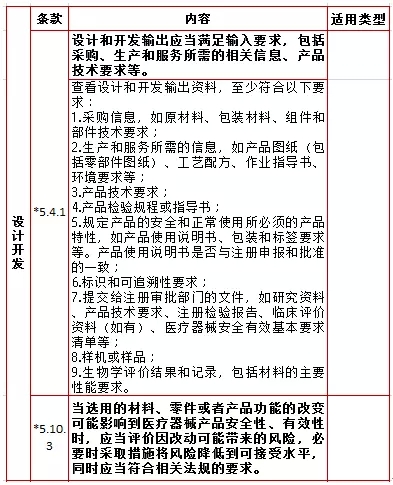 6、采购,计12项
6、采购,计12项 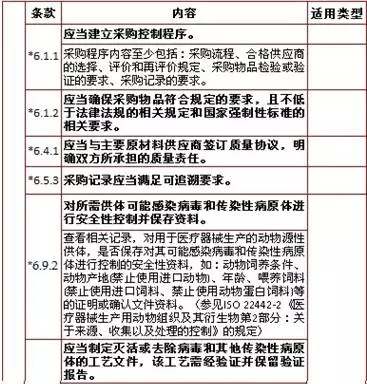

 7、生产管理,计11项
7、生产管理,计11项 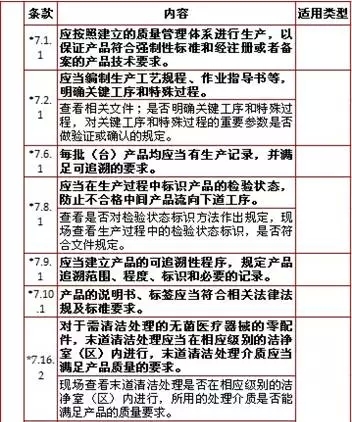
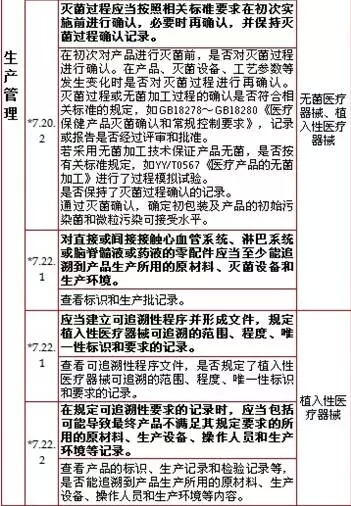 8、质量控制,计8项
8、质量控制,计8项 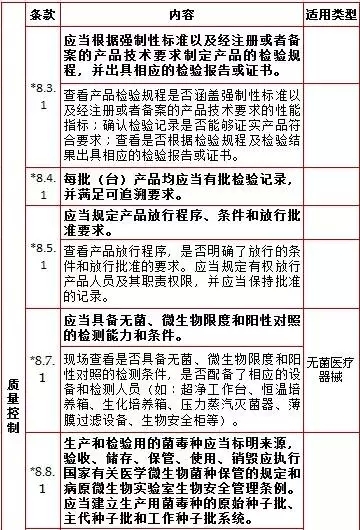
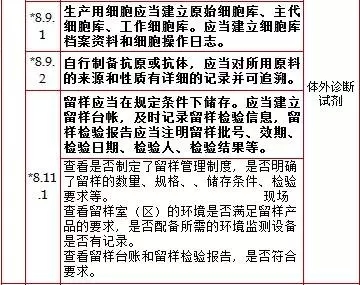 9、销售和售后服务,计1项 *9.1.1 应当建立产品销售记录,并满足可追溯要求。 10、不合格品控制,计1项
9、销售和售后服务,计1项 *9.1.1 应当建立产品销售记录,并满足可追溯要求。 10、不合格品控制,计1项  11、不良事件监测、分析和改进,计4项
11、不良事件监测、分析和改进,计4项  经过梳理,中国医疗器械发现,此次督查不可不谓时间紧、任务重、动真格。 比如安徽省要求在今年6月底前就完成所有第三类医疗器械生产企业质量管理体系的全面检查。而浙江全省236家第三类医疗器械生产企业中,已有20家被限期整改,6家被停产整改,还有4家主动停产,1家注销等等,占比近15%。预测日后会有更多省份陆续展开相关督查工作,新一轮督查风暴即将来袭! 此外,国家局要求,第三类以外的其他医疗器械生产企业也应于2018年1月1日符合《规范》要求。相信在未来两年时间里,风波将席卷整个医械圈,而不符合规范者将被淘汰出局。 你,做好准备了吗?
经过梳理,中国医疗器械发现,此次督查不可不谓时间紧、任务重、动真格。 比如安徽省要求在今年6月底前就完成所有第三类医疗器械生产企业质量管理体系的全面检查。而浙江全省236家第三类医疗器械生产企业中,已有20家被限期整改,6家被停产整改,还有4家主动停产,1家注销等等,占比近15%。预测日后会有更多省份陆续展开相关督查工作,新一轮督查风暴即将来袭! 此外,国家局要求,第三类以外的其他医疗器械生产企业也应于2018年1月1日符合《规范》要求。相信在未来两年时间里,风波将席卷整个医械圈,而不符合规范者将被淘汰出局。 你,做好准备了吗?






