 (来源:CDE官网)
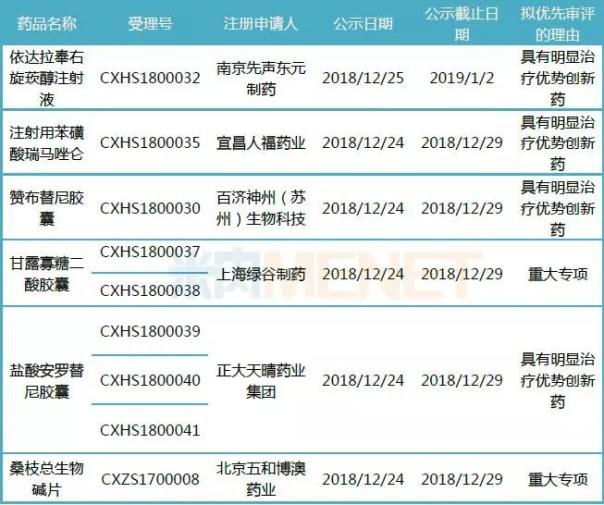
36个拟优先审评的受理号中,有9个为国内新药上市申请,涉及6个产品。南京先声东元制药的依达拉奉右旋莰醇注射液、宜昌人福药业的注射用苯磺酸瑞马唑仑、百济神州(苏州)生物科技的赞布替尼胶囊以及正大天晴药业集团盐酸安罗替尼胶囊拟优先审评的理由为具有明显治疗优势创新药。
图1:2013-2017年中国公立医疗机构终端依达拉奉的年度销售情况(单位:万元)
(来源:CDE官网)
36个拟优先审评的受理号中,有9个为国内新药上市申请,涉及6个产品。南京先声东元制药的依达拉奉右旋莰醇注射液、宜昌人福药业的注射用苯磺酸瑞马唑仑、百济神州(苏州)生物科技的赞布替尼胶囊以及正大天晴药业集团盐酸安罗替尼胶囊拟优先审评的理由为具有明显治疗优势创新药。
图1:2013-2017年中国公立医疗机构终端依达拉奉的年度销售情况(单位:万元)
 (来源:米内网中国公立医疗机构终端竞争格局)
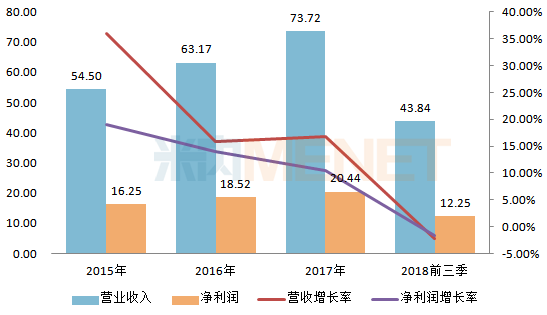
依达拉奉是一种脑保护剂(自由基清除剂),用于改善急性脑梗塞所致的神经症状、日常活动能力和功能障碍。据米内网数据显示,2017年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端,依达拉奉的销售额超过了55亿元,主要产品为依达拉奉注射液,领军企业南京先声东元制药市场份额为37.57%。目前该产品未有仿制药通过一致性评价,仅有南京先声东元制药的一致性评价补充申请在审评审批中。
研究表明,依达拉奉右旋莰醇注射液能够清除脑卒中后自由基,抑制炎性细胞因子表达,阻断自由基与炎性互生循环,发挥多机制协同作用。该产品较依达拉奉疗效提高38%、剂量降至1/10、治疗时间窗延长一倍疗效显著、安全性高,是用于脑卒中的新机制新药。
注射用苯磺酸瑞马唑仑是一种新型的超短效镇静麻醉药,具有水溶性以及半衰期短的特点,与同类产品相比起效更快,代谢迅速且代谢产物活性较低,可以减少药物之间的相互作用,具有良好的有效性和安全性,该产品拟用于手术麻醉。据米内网数据显示,作为& 麻醉药一哥& 的宜昌人福药业2017年在中国公立医疗机构终端麻醉剂市场的销售额超过了22亿元,新品获批后将有助企业站稳TOP1地位。
赞布替尼胶囊是由百济神州自主研发,可阻断相关信号传递,抑制恶性增殖B细胞的生长并杀死肿瘤细胞。目前,全球已有两款BTK抑制剂上市,分别是来自强生/艾伯维的Ibrutinib(伊布替尼)和阿斯利康的Acalabrutinib(阿卡替尼)。伊布替尼于2017年8月获国家药监局批准,11月正式上市。据CDE官网数据显示,百济神州(苏州)生物科技的赞布替尼(CXHS1800023)以及赞布替尼胶囊(CXHS1800024)在2018年11月已纳入优先审评。
正大天晴的1.1类新药盐酸安罗替尼胶囊得益于优先审评,于2018年5月获国家药监局批准上市,本次提交的为第三个适应症(推测为小细胞肺癌)的上市申请,据CDE官网数据显示第二个适应症用于治疗软组织肉瘤的上市申请也于11月纳入了优先审评。安罗替尼是新型小分子多靶点酪氨酸激酶抑制剂,可有效抑制VEGFR、PDGFR、FGFR、c-Kit等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的双重功效。业内专家指出,安罗替尼有望成为晚期非小细胞肺癌患者三线治疗的标准用药。盐酸安罗替尼胶囊已进入新医保目录。
10个进口新药申请上市,2个儿童药,3个单抗
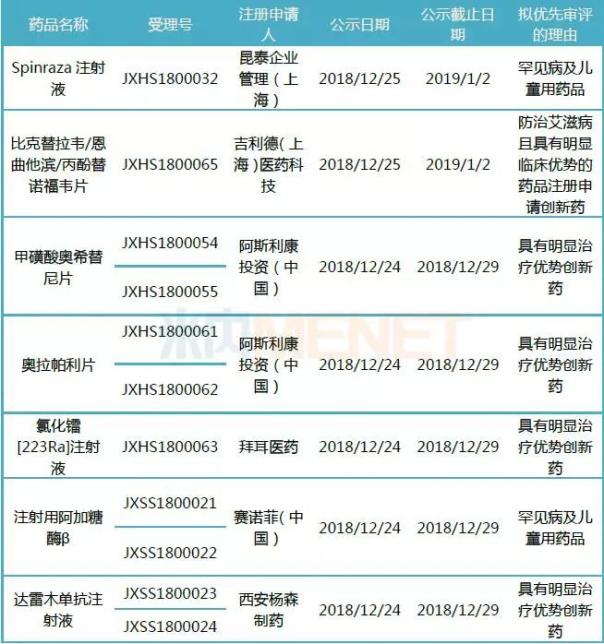
带量采购政策启动后,药品创新再次引来国内制药企业的重视,药品上市获批速度也在加快。按照中共中央、国务院对深化药品审评审批制度改革的有关精神,国家药监局继续加快境外已上市新药在我国进口注册的速度,对治疗罕见病的药品和防治严重危及生命疾病的部分药品优化审评程序,简化上市要求,确保我国患者早日用上境外已上市新药。本次公示的拟优先审评的产品有10个为进口新药,其中涉及罕见病及儿童用药品2个。
表2:最新公示拟优先审评的进口新药上市申请
(来源:米内网中国公立医疗机构终端竞争格局)
依达拉奉是一种脑保护剂(自由基清除剂),用于改善急性脑梗塞所致的神经症状、日常活动能力和功能障碍。据米内网数据显示,2017年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端,依达拉奉的销售额超过了55亿元,主要产品为依达拉奉注射液,领军企业南京先声东元制药市场份额为37.57%。目前该产品未有仿制药通过一致性评价,仅有南京先声东元制药的一致性评价补充申请在审评审批中。
研究表明,依达拉奉右旋莰醇注射液能够清除脑卒中后自由基,抑制炎性细胞因子表达,阻断自由基与炎性互生循环,发挥多机制协同作用。该产品较依达拉奉疗效提高38%、剂量降至1/10、治疗时间窗延长一倍疗效显著、安全性高,是用于脑卒中的新机制新药。
注射用苯磺酸瑞马唑仑是一种新型的超短效镇静麻醉药,具有水溶性以及半衰期短的特点,与同类产品相比起效更快,代谢迅速且代谢产物活性较低,可以减少药物之间的相互作用,具有良好的有效性和安全性,该产品拟用于手术麻醉。据米内网数据显示,作为& 麻醉药一哥& 的宜昌人福药业2017年在中国公立医疗机构终端麻醉剂市场的销售额超过了22亿元,新品获批后将有助企业站稳TOP1地位。
赞布替尼胶囊是由百济神州自主研发,可阻断相关信号传递,抑制恶性增殖B细胞的生长并杀死肿瘤细胞。目前,全球已有两款BTK抑制剂上市,分别是来自强生/艾伯维的Ibrutinib(伊布替尼)和阿斯利康的Acalabrutinib(阿卡替尼)。伊布替尼于2017年8月获国家药监局批准,11月正式上市。据CDE官网数据显示,百济神州(苏州)生物科技的赞布替尼(CXHS1800023)以及赞布替尼胶囊(CXHS1800024)在2018年11月已纳入优先审评。
正大天晴的1.1类新药盐酸安罗替尼胶囊得益于优先审评,于2018年5月获国家药监局批准上市,本次提交的为第三个适应症(推测为小细胞肺癌)的上市申请,据CDE官网数据显示第二个适应症用于治疗软组织肉瘤的上市申请也于11月纳入了优先审评。安罗替尼是新型小分子多靶点酪氨酸激酶抑制剂,可有效抑制VEGFR、PDGFR、FGFR、c-Kit等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的双重功效。业内专家指出,安罗替尼有望成为晚期非小细胞肺癌患者三线治疗的标准用药。盐酸安罗替尼胶囊已进入新医保目录。
10个进口新药申请上市,2个儿童药,3个单抗
带量采购政策启动后,药品创新再次引来国内制药企业的重视,药品上市获批速度也在加快。按照中共中央、国务院对深化药品审评审批制度改革的有关精神,国家药监局继续加快境外已上市新药在我国进口注册的速度,对治疗罕见病的药品和防治严重危及生命疾病的部分药品优化审评程序,简化上市要求,确保我国患者早日用上境外已上市新药。本次公示的拟优先审评的产品有10个为进口新药,其中涉及罕见病及儿童用药品2个。
表2:最新公示拟优先审评的进口新药上市申请
 (来源:CDE官网)
Spinraza注射液为全球首个用于治疗儿童和成人脊髓性肌萎缩(SMA)的新药,于2016年12月23日获FDA批准。据悉,SMA是一种遗传性疾病,由于失去控制运动的下运动神经元而引起虚弱和肌肉萎缩,发病年龄、症状和进展速率具有广泛的变异性,Spinraza被批准跨越脊髓肌肉萎缩患者范围使用。目前,该产品已在美国、欧盟、日本上市。
注射用阿加糖酶β的适应症为罕见病法布雷病,法布雷病为α-半乳糖苷酶缺乏引起糖鞘脂代谢障碍,是一种罕见的遗传性疾病。
达雷木单抗注射液由强生公司开发,为首个上市的治疗多发性骨髓瘤的单克隆抗体药物,于2015年11月通过优先审评获得FDA批准上市。目前,在国内多发性骨髓瘤用药市场中,来那度胺和硼替佐米等一线用药已纳入了医保目录。
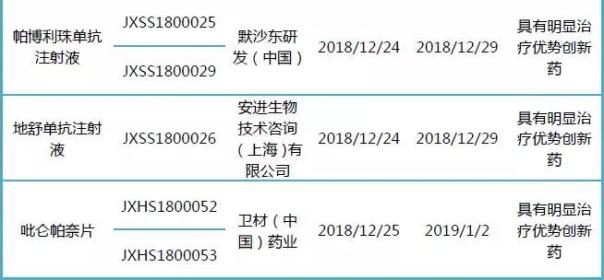
帕博利珠单抗注射液在2018年7月26日正式获国家药监局批准上市,在中国获批的适应症是晚期黑色素瘤治疗,主要用于治疗一线治疗(患者初次化疗或手术后的辅助化疗)已经失败,黑色素瘤不可切除或呈现转移性的患者。2018年11月,帕博利珠单抗注射液的第二个适应症的上市申请被纳入优先审评,此次推测为第三个适应症的上市申请。
地舒单抗注射液适用于治疗有增加骨折危险的绝经后妇女的骨质疏松(有骨质疏松史或多发性骨折危险因素)或不能耐受现有其它骨质疏松治疗药的患者。该产品于2010年5月、6月分别在欧盟和美国获批上市,欧盟还批准该产品用于治疗有增加骨折危险的前列腺癌男性患者激素缺失引起的骨质丢失。
再有5个仿制药国外转内销,东阳光药业占3个
表3:最新公示拟优先审评的仿制药上市申请
(来源:CDE官网)
Spinraza注射液为全球首个用于治疗儿童和成人脊髓性肌萎缩(SMA)的新药,于2016年12月23日获FDA批准。据悉,SMA是一种遗传性疾病,由于失去控制运动的下运动神经元而引起虚弱和肌肉萎缩,发病年龄、症状和进展速率具有广泛的变异性,Spinraza被批准跨越脊髓肌肉萎缩患者范围使用。目前,该产品已在美国、欧盟、日本上市。
注射用阿加糖酶β的适应症为罕见病法布雷病,法布雷病为α-半乳糖苷酶缺乏引起糖鞘脂代谢障碍,是一种罕见的遗传性疾病。
达雷木单抗注射液由强生公司开发,为首个上市的治疗多发性骨髓瘤的单克隆抗体药物,于2015年11月通过优先审评获得FDA批准上市。目前,在国内多发性骨髓瘤用药市场中,来那度胺和硼替佐米等一线用药已纳入了医保目录。
帕博利珠单抗注射液在2018年7月26日正式获国家药监局批准上市,在中国获批的适应症是晚期黑色素瘤治疗,主要用于治疗一线治疗(患者初次化疗或手术后的辅助化疗)已经失败,黑色素瘤不可切除或呈现转移性的患者。2018年11月,帕博利珠单抗注射液的第二个适应症的上市申请被纳入优先审评,此次推测为第三个适应症的上市申请。
地舒单抗注射液适用于治疗有增加骨折危险的绝经后妇女的骨质疏松(有骨质疏松史或多发性骨折危险因素)或不能耐受现有其它骨质疏松治疗药的患者。该产品于2010年5月、6月分别在欧盟和美国获批上市,欧盟还批准该产品用于治疗有增加骨折危险的前列腺癌男性患者激素缺失引起的骨质丢失。
再有5个仿制药国外转内销,东阳光药业占3个
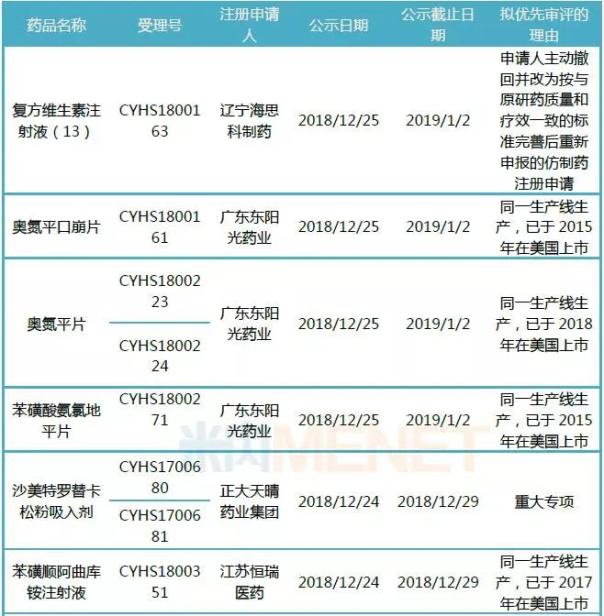
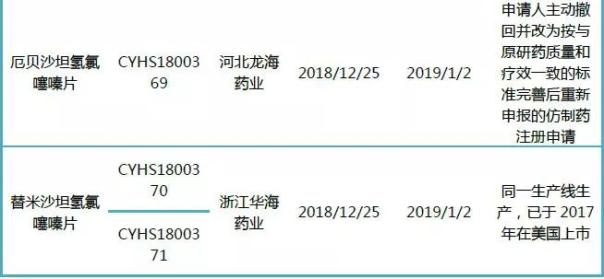
表3:最新公示拟优先审评的仿制药上市申请
 (来源:CDE官网)
《CFDA关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)》中提到,支持中国境内企业生产的在欧盟、美国或日本批准上市的药品在中国上市,由国家食品药品监督管理总局审评通过后,视同通过一致性评价。
2018年,一致性评价进行得热火朝天,越来越多药企通过优先审评实现弯道超车。最新公示的8个拟优先审评的仿制药中,东阳光药业奥氮平口崩片、奥氮平片、苯磺酸氨氯地平片,恒瑞医药的苯磺顺阿曲库铵注射液以及华海药业的替米沙坦氢氯噻嗪片均已在美国上市,且采用同一生产线。
表4:目前获益优先审评视同通过一致性评价的产品情况
(来源:CDE官网)
《CFDA关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)》中提到,支持中国境内企业生产的在欧盟、美国或日本批准上市的药品在中国上市,由国家食品药品监督管理总局审评通过后,视同通过一致性评价。
2018年,一致性评价进行得热火朝天,越来越多药企通过优先审评实现弯道超车。最新公示的8个拟优先审评的仿制药中,东阳光药业奥氮平口崩片、奥氮平片、苯磺酸氨氯地平片,恒瑞医药的苯磺顺阿曲库铵注射液以及华海药业的替米沙坦氢氯噻嗪片均已在美国上市,且采用同一生产线。
表4:目前获益优先审评视同通过一致性评价的产品情况
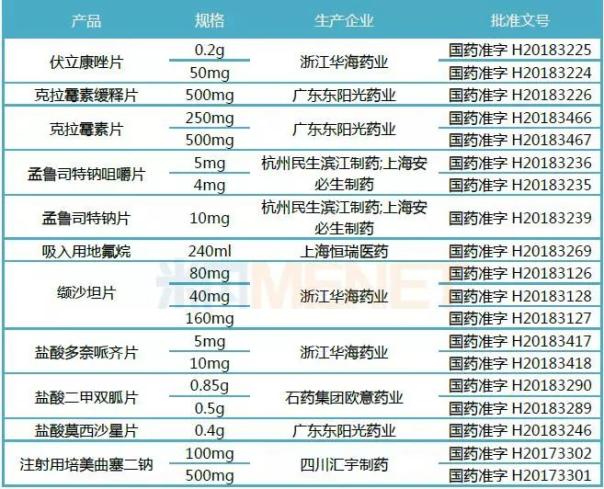 (来源:米内网数据库)
截至2018年12月25日,11个国外上市产品通过优先审评通道,快速完成了审评审批,收录进了上市药品目录集,收录类别为按化学药品新注册分类批准的仿制药,视同通过一致性评价。其中,华海药业、恒瑞医药、石药集团、东阳光药业等国内龙头药企表现出色,后续有望获批更多产品。
注:统计截至2018年12月25日17:00
资料来源:CDE官网、米内网数据库
(来源:米内网数据库)
截至2018年12月25日,11个国外上市产品通过优先审评通道,快速完成了审评审批,收录进了上市药品目录集,收录类别为按化学药品新注册分类批准的仿制药,视同通过一致性评价。其中,华海药业、恒瑞医药、石药集团、东阳光药业等国内龙头药企表现出色,后续有望获批更多产品。
注:统计截至2018年12月25日17:00
资料来源:CDE官网、米内网数据库







