 (图片来源:insight 数据库)
从申请历史来看,信迪利单抗的申请历程可谓是一波三折:
今年4月下旬,国家药监局药品审评中心(CDE)发出公告,发布第二十八批拟纳入优先审评程序药品注册申请的公示名单,其中,默沙东的帕博利珠单抗注射液(Keytruda),信达生物的信迪利单抗注射液、恒瑞医药的注射用卡瑞利珠单抗以及君实生物的特瑞普利单抗注射液都位列其中。
看似进程一致,但之后的上市时间却不尽相同。尤其是信达与君实之争:据悉,从临床进度和递交上市申请的时间来看,二者不相上下,获批的时间相差也不会太大。
事实也确实如此,二者的产品上市时间相差不到一个月,最终,& 首个国产PD-1单抗& 的名头花落君实生物。
12月17日,国家药监局批准了君实生物的上市申请,从申报到获批上市,仅用了不到10个月的时间。
但其实,原本更早的应该是信达生物。
2017 年 12 月 13 日,信达生物的信迪单抗提交上市申请,用于治疗霍奇金淋巴瘤,这是首家递交国产PD-1单抗上市的企业。
2018年3月,信达生物发声称:公司主动撤回上市申请,但正在补充材料再次提交。
3月20日,君实生物的新药申请已获得受理。4月19日,CDE受理信达生物重新提交的上市申请,从此开始,信达生物一直落后君实生物一个身位。
▍400亿市场,4+4的竞争格局
据海通证券分析显示,PD-1和PD-L1国内市场空间超过400亿元,其免疫治疗的作用机制和临床表现使其具有较为广阔的市场空间。
在兴业证券分析中,国内市场基本形成了4(跨国药企:百时美施贵宝、默沙东、罗氏、阿斯利康)+4(本土创新药企:恒瑞医药、君实生物、信达生物、百济神州)的竞争格局。
据资料显示,4月23日,恒瑞医药的卡瑞利珠单抗的上市申请在4月23日获得了CDE的受理,仅比信达生物的4月19日慢4天,相信不久的将来,恒瑞医药的卡瑞利珠单抗也会很快上市。
进度稍慢的是百济神州,因同步开展国际多中心临床,整体进度稍慢,但其BGB-A317的食管癌、肝癌等适应症的国际多中心临床已进行到Ⅲ临床,比起其他企业,其海外研发进程较快。
此外,目前PD-1是个热门靶点,多企业在此布局可以得出。因此,最终定价就成了值得关注的问题。
据了解,K药是有& 3+3& 的慈善赠药,患者需要负担9个周期,约16万,O药是36万一年——这两个药的价格都是全球最低。
K药中国内地零售价为17918元/100mg,美国售价为4800美金(33000RMB)/100mg,香港售价为30000港币(26200RMB)/100mg。O药的价格为100mg/10ml 9260元(大瓶)、40mg/4ml 4591元(小瓶)。
而君实生物的售价此前也有相关风声:定价5000-6000元,240mg。因此,信达生物的定价也值得关注。
(图片来源:insight 数据库)
从申请历史来看,信迪利单抗的申请历程可谓是一波三折:
今年4月下旬,国家药监局药品审评中心(CDE)发出公告,发布第二十八批拟纳入优先审评程序药品注册申请的公示名单,其中,默沙东的帕博利珠单抗注射液(Keytruda),信达生物的信迪利单抗注射液、恒瑞医药的注射用卡瑞利珠单抗以及君实生物的特瑞普利单抗注射液都位列其中。
看似进程一致,但之后的上市时间却不尽相同。尤其是信达与君实之争:据悉,从临床进度和递交上市申请的时间来看,二者不相上下,获批的时间相差也不会太大。
事实也确实如此,二者的产品上市时间相差不到一个月,最终,& 首个国产PD-1单抗& 的名头花落君实生物。
12月17日,国家药监局批准了君实生物的上市申请,从申报到获批上市,仅用了不到10个月的时间。
但其实,原本更早的应该是信达生物。
2017 年 12 月 13 日,信达生物的信迪单抗提交上市申请,用于治疗霍奇金淋巴瘤,这是首家递交国产PD-1单抗上市的企业。
2018年3月,信达生物发声称:公司主动撤回上市申请,但正在补充材料再次提交。
3月20日,君实生物的新药申请已获得受理。4月19日,CDE受理信达生物重新提交的上市申请,从此开始,信达生物一直落后君实生物一个身位。
▍400亿市场,4+4的竞争格局
据海通证券分析显示,PD-1和PD-L1国内市场空间超过400亿元,其免疫治疗的作用机制和临床表现使其具有较为广阔的市场空间。
在兴业证券分析中,国内市场基本形成了4(跨国药企:百时美施贵宝、默沙东、罗氏、阿斯利康)+4(本土创新药企:恒瑞医药、君实生物、信达生物、百济神州)的竞争格局。
据资料显示,4月23日,恒瑞医药的卡瑞利珠单抗的上市申请在4月23日获得了CDE的受理,仅比信达生物的4月19日慢4天,相信不久的将来,恒瑞医药的卡瑞利珠单抗也会很快上市。
进度稍慢的是百济神州,因同步开展国际多中心临床,整体进度稍慢,但其BGB-A317的食管癌、肝癌等适应症的国际多中心临床已进行到Ⅲ临床,比起其他企业,其海外研发进程较快。
此外,目前PD-1是个热门靶点,多企业在此布局可以得出。因此,最终定价就成了值得关注的问题。
据了解,K药是有& 3+3& 的慈善赠药,患者需要负担9个周期,约16万,O药是36万一年——这两个药的价格都是全球最低。
K药中国内地零售价为17918元/100mg,美国售价为4800美金(33000RMB)/100mg,香港售价为30000港币(26200RMB)/100mg。O药的价格为100mg/10ml 9260元(大瓶)、40mg/4ml 4591元(小瓶)。
而君实生物的售价此前也有相关风声:定价5000-6000元,240mg。因此,信达生物的定价也值得关注。
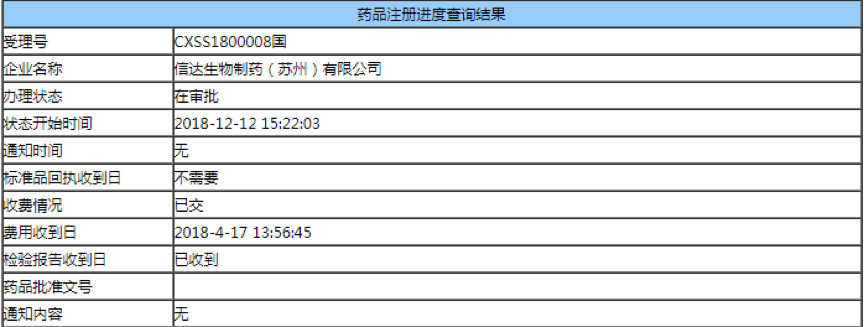
医药网12月28日讯 刚刚,据insight医药情报局报道,其数据库显示信达PD-1(信迪利单抗注射液)CFDA 办理状态变更为& 在审批& 。
据悉,知情人士向 Insight 数据库透露,信迪利单抗已获 CFDA 批准上市。
 (图片来源:insight 数据库)
从申请历史来看,信迪利单抗的申请历程可谓是一波三折:
今年4月下旬,国家药监局药品审评中心(CDE)发出公告,发布第二十八批拟纳入优先审评程序药品注册申请的公示名单,其中,默沙东的帕博利珠单抗注射液(Keytruda),信达生物的信迪利单抗注射液、恒瑞医药的注射用卡瑞利珠单抗以及君实生物的特瑞普利单抗注射液都位列其中。
看似进程一致,但之后的上市时间却不尽相同。尤其是信达与君实之争:据悉,从临床进度和递交上市申请的时间来看,二者不相上下,获批的时间相差也不会太大。
事实也确实如此,二者的产品上市时间相差不到一个月,最终,& 首个国产PD-1单抗& 的名头花落君实生物。
12月17日,国家药监局批准了君实生物的上市申请,从申报到获批上市,仅用了不到10个月的时间。
但其实,原本更早的应该是信达生物。
2017 年 12 月 13 日,信达生物的信迪单抗提交上市申请,用于治疗霍奇金淋巴瘤,这是首家递交国产PD-1单抗上市的企业。
2018年3月,信达生物发声称:公司主动撤回上市申请,但正在补充材料再次提交。
3月20日,君实生物的新药申请已获得受理。4月19日,CDE受理信达生物重新提交的上市申请,从此开始,信达生物一直落后君实生物一个身位。
▍400亿市场,4+4的竞争格局
据海通证券分析显示,PD-1和PD-L1国内市场空间超过400亿元,其免疫治疗的作用机制和临床表现使其具有较为广阔的市场空间。
在兴业证券分析中,国内市场基本形成了4(跨国药企:百时美施贵宝、默沙东、罗氏、阿斯利康)+4(本土创新药企:恒瑞医药、君实生物、信达生物、百济神州)的竞争格局。
据资料显示,4月23日,恒瑞医药的卡瑞利珠单抗的上市申请在4月23日获得了CDE的受理,仅比信达生物的4月19日慢4天,相信不久的将来,恒瑞医药的卡瑞利珠单抗也会很快上市。
进度稍慢的是百济神州,因同步开展国际多中心临床,整体进度稍慢,但其BGB-A317的食管癌、肝癌等适应症的国际多中心临床已进行到Ⅲ临床,比起其他企业,其海外研发进程较快。
此外,目前PD-1是个热门靶点,多企业在此布局可以得出。因此,最终定价就成了值得关注的问题。
据了解,K药是有& 3+3& 的慈善赠药,患者需要负担9个周期,约16万,O药是36万一年——这两个药的价格都是全球最低。
K药中国内地零售价为17918元/100mg,美国售价为4800美金(33000RMB)/100mg,香港售价为30000港币(26200RMB)/100mg。O药的价格为100mg/10ml 9260元(大瓶)、40mg/4ml 4591元(小瓶)。
而君实生物的售价此前也有相关风声:定价5000-6000元,240mg。因此,信达生物的定价也值得关注。
(图片来源:insight 数据库)
从申请历史来看,信迪利单抗的申请历程可谓是一波三折:
今年4月下旬,国家药监局药品审评中心(CDE)发出公告,发布第二十八批拟纳入优先审评程序药品注册申请的公示名单,其中,默沙东的帕博利珠单抗注射液(Keytruda),信达生物的信迪利单抗注射液、恒瑞医药的注射用卡瑞利珠单抗以及君实生物的特瑞普利单抗注射液都位列其中。
看似进程一致,但之后的上市时间却不尽相同。尤其是信达与君实之争:据悉,从临床进度和递交上市申请的时间来看,二者不相上下,获批的时间相差也不会太大。
事实也确实如此,二者的产品上市时间相差不到一个月,最终,& 首个国产PD-1单抗& 的名头花落君实生物。
12月17日,国家药监局批准了君实生物的上市申请,从申报到获批上市,仅用了不到10个月的时间。
但其实,原本更早的应该是信达生物。
2017 年 12 月 13 日,信达生物的信迪单抗提交上市申请,用于治疗霍奇金淋巴瘤,这是首家递交国产PD-1单抗上市的企业。
2018年3月,信达生物发声称:公司主动撤回上市申请,但正在补充材料再次提交。
3月20日,君实生物的新药申请已获得受理。4月19日,CDE受理信达生物重新提交的上市申请,从此开始,信达生物一直落后君实生物一个身位。
▍400亿市场,4+4的竞争格局
据海通证券分析显示,PD-1和PD-L1国内市场空间超过400亿元,其免疫治疗的作用机制和临床表现使其具有较为广阔的市场空间。
在兴业证券分析中,国内市场基本形成了4(跨国药企:百时美施贵宝、默沙东、罗氏、阿斯利康)+4(本土创新药企:恒瑞医药、君实生物、信达生物、百济神州)的竞争格局。
据资料显示,4月23日,恒瑞医药的卡瑞利珠单抗的上市申请在4月23日获得了CDE的受理,仅比信达生物的4月19日慢4天,相信不久的将来,恒瑞医药的卡瑞利珠单抗也会很快上市。
进度稍慢的是百济神州,因同步开展国际多中心临床,整体进度稍慢,但其BGB-A317的食管癌、肝癌等适应症的国际多中心临床已进行到Ⅲ临床,比起其他企业,其海外研发进程较快。
此外,目前PD-1是个热门靶点,多企业在此布局可以得出。因此,最终定价就成了值得关注的问题。
据了解,K药是有& 3+3& 的慈善赠药,患者需要负担9个周期,约16万,O药是36万一年——这两个药的价格都是全球最低。
K药中国内地零售价为17918元/100mg,美国售价为4800美金(33000RMB)/100mg,香港售价为30000港币(26200RMB)/100mg。O药的价格为100mg/10ml 9260元(大瓶)、40mg/4ml 4591元(小瓶)。
而君实生物的售价此前也有相关风声:定价5000-6000元,240mg。因此,信达生物的定价也值得关注。
 (图片来源:insight 数据库)
从申请历史来看,信迪利单抗的申请历程可谓是一波三折:
今年4月下旬,国家药监局药品审评中心(CDE)发出公告,发布第二十八批拟纳入优先审评程序药品注册申请的公示名单,其中,默沙东的帕博利珠单抗注射液(Keytruda),信达生物的信迪利单抗注射液、恒瑞医药的注射用卡瑞利珠单抗以及君实生物的特瑞普利单抗注射液都位列其中。
看似进程一致,但之后的上市时间却不尽相同。尤其是信达与君实之争:据悉,从临床进度和递交上市申请的时间来看,二者不相上下,获批的时间相差也不会太大。
事实也确实如此,二者的产品上市时间相差不到一个月,最终,& 首个国产PD-1单抗& 的名头花落君实生物。
12月17日,国家药监局批准了君实生物的上市申请,从申报到获批上市,仅用了不到10个月的时间。
但其实,原本更早的应该是信达生物。
2017 年 12 月 13 日,信达生物的信迪单抗提交上市申请,用于治疗霍奇金淋巴瘤,这是首家递交国产PD-1单抗上市的企业。
2018年3月,信达生物发声称:公司主动撤回上市申请,但正在补充材料再次提交。
3月20日,君实生物的新药申请已获得受理。4月19日,CDE受理信达生物重新提交的上市申请,从此开始,信达生物一直落后君实生物一个身位。
▍400亿市场,4+4的竞争格局
据海通证券分析显示,PD-1和PD-L1国内市场空间超过400亿元,其免疫治疗的作用机制和临床表现使其具有较为广阔的市场空间。
在兴业证券分析中,国内市场基本形成了4(跨国药企:百时美施贵宝、默沙东、罗氏、阿斯利康)+4(本土创新药企:恒瑞医药、君实生物、信达生物、百济神州)的竞争格局。
据资料显示,4月23日,恒瑞医药的卡瑞利珠单抗的上市申请在4月23日获得了CDE的受理,仅比信达生物的4月19日慢4天,相信不久的将来,恒瑞医药的卡瑞利珠单抗也会很快上市。
进度稍慢的是百济神州,因同步开展国际多中心临床,整体进度稍慢,但其BGB-A317的食管癌、肝癌等适应症的国际多中心临床已进行到Ⅲ临床,比起其他企业,其海外研发进程较快。
此外,目前PD-1是个热门靶点,多企业在此布局可以得出。因此,最终定价就成了值得关注的问题。
据了解,K药是有& 3+3& 的慈善赠药,患者需要负担9个周期,约16万,O药是36万一年——这两个药的价格都是全球最低。
K药中国内地零售价为17918元/100mg,美国售价为4800美金(33000RMB)/100mg,香港售价为30000港币(26200RMB)/100mg。O药的价格为100mg/10ml 9260元(大瓶)、40mg/4ml 4591元(小瓶)。
而君实生物的售价此前也有相关风声:定价5000-6000元,240mg。因此,信达生物的定价也值得关注。
(图片来源:insight 数据库)
从申请历史来看,信迪利单抗的申请历程可谓是一波三折:
今年4月下旬,国家药监局药品审评中心(CDE)发出公告,发布第二十八批拟纳入优先审评程序药品注册申请的公示名单,其中,默沙东的帕博利珠单抗注射液(Keytruda),信达生物的信迪利单抗注射液、恒瑞医药的注射用卡瑞利珠单抗以及君实生物的特瑞普利单抗注射液都位列其中。
看似进程一致,但之后的上市时间却不尽相同。尤其是信达与君实之争:据悉,从临床进度和递交上市申请的时间来看,二者不相上下,获批的时间相差也不会太大。
事实也确实如此,二者的产品上市时间相差不到一个月,最终,& 首个国产PD-1单抗& 的名头花落君实生物。
12月17日,国家药监局批准了君实生物的上市申请,从申报到获批上市,仅用了不到10个月的时间。
但其实,原本更早的应该是信达生物。
2017 年 12 月 13 日,信达生物的信迪单抗提交上市申请,用于治疗霍奇金淋巴瘤,这是首家递交国产PD-1单抗上市的企业。
2018年3月,信达生物发声称:公司主动撤回上市申请,但正在补充材料再次提交。
3月20日,君实生物的新药申请已获得受理。4月19日,CDE受理信达生物重新提交的上市申请,从此开始,信达生物一直落后君实生物一个身位。
▍400亿市场,4+4的竞争格局
据海通证券分析显示,PD-1和PD-L1国内市场空间超过400亿元,其免疫治疗的作用机制和临床表现使其具有较为广阔的市场空间。
在兴业证券分析中,国内市场基本形成了4(跨国药企:百时美施贵宝、默沙东、罗氏、阿斯利康)+4(本土创新药企:恒瑞医药、君实生物、信达生物、百济神州)的竞争格局。
据资料显示,4月23日,恒瑞医药的卡瑞利珠单抗的上市申请在4月23日获得了CDE的受理,仅比信达生物的4月19日慢4天,相信不久的将来,恒瑞医药的卡瑞利珠单抗也会很快上市。
进度稍慢的是百济神州,因同步开展国际多中心临床,整体进度稍慢,但其BGB-A317的食管癌、肝癌等适应症的国际多中心临床已进行到Ⅲ临床,比起其他企业,其海外研发进程较快。
此外,目前PD-1是个热门靶点,多企业在此布局可以得出。因此,最终定价就成了值得关注的问题。
据了解,K药是有& 3+3& 的慈善赠药,患者需要负担9个周期,约16万,O药是36万一年——这两个药的价格都是全球最低。
K药中国内地零售价为17918元/100mg,美国售价为4800美金(33000RMB)/100mg,香港售价为30000港币(26200RMB)/100mg。O药的价格为100mg/10ml 9260元(大瓶)、40mg/4ml 4591元(小瓶)。
而君实生物的售价此前也有相关风声:定价5000-6000元,240mg。因此,信达生物的定价也值得关注。







